กรดแก่ หมายถึงกรดที่เมื่อละลายน้ำแล้วสามารถแตกตัวเป็นไอออนได้ 100 %
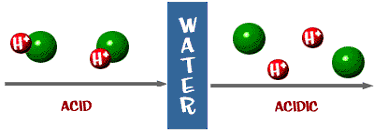
ให้สังเกตการแตกตัวของกรดแก่ HCl เปรียบเทียบกับการแตกตัวของกรดอ่อน HF ซึ่งการแตกตัวเป็นดังสมการ
HCl(aq) ——-> H +(aq) + Cl-(aq)
0.1 mol/dm3 0.1 mol/dm3 0.1 mol/dm3
HF(aq)  H +(aq) + F-(aq)
H +(aq) + F-(aq)
 H +(aq) + F-(aq)
H +(aq) + F-(aq)
0.1 mol/dm3 x mol/dm3 x mol/dm3
ตัวอย่างกรดแก่สามัญ ได้แก่
สูตรเคมี
|
ชื่อกรด
|
HCl
|
ไฮโดรคลอริก(hydrochloric acid)
|
HBr
|
ไฮโดรโบรมิก(hydrobromic acid)
|
HI
|
ไฮโดรไอโอดิก(hydroiodic acid)
|
HNO3
|
ไนตริก(nitric acid)
|
HClO4
|
เปอร์คลอริก(perchloric acid)
|
H2SO4
|
ซัลฟิวริก(sulfuric acid)
|
กรด HCl HBr HI HNO3 HClO4 เป็นกรดที่ 1 โมเลกุลสามารถแตกตัวให้ 1 H+ เรียกกรดที่ 1 โมเลกุลแตกตัวให้ 1 H+ นี้ว่ากรดมอนอโปรติก(monoprotic) ซึ่งการแตกตัวของกรดแก่มอนอโปรติก จะมีลักษณะคล้ายกันคือแตกตัวให้ H+(ซึ่งรวมกับน้ำกลายเป็นไฮโดรเนียมไอออน(H3O+)) และไอออนลบที่มีความเข้มข้นเท่ากันและเท่ากับความเข้มข้นของกรด ดังสมการ
HA(aq) + H2O(l) —–> A-(aq) + H3O+(aq)
ตัวอย่าง HClO4(aq) + H2O(l) —–> ClO4-(aq) + H3O+(aq)
2 mol 2 mol 2 mol
0.5 mol/dm3 0.5 mol/dm3 0.5 mol/dm3
HNO3(aq) + H2O(l) —–> NO3-(aq) + H3O+(aq)
3 mol 3 mol 3 mol
0.6 mol/dm3 0.6 mol/dm3 0.6 mol/dm3
สรุป กรดแก่มอนอโปรติกความเข้มข้นของไฮโดรเนียม = ความเข้มข้นของกรดหรือ [H3O+] = [HA] |
กรณีกรดแก่ H2SO4 เป็นกรดที่ 1 โมเลกุลสามารถแตกตัวให้ H+ ได้ 2 ไอออนซึ่งเรียกว่ากรด diprotic ซึ่งกรดที่
สามารถแตกตัวให้ H+ หลายไอออนอาจเรียกรวมๆ ว่ากรด polyprotic กรด H2SO4 สามารถแตกตัวได้ 2 ขั้น ดังนี้
ขั้นที่ 1 H2SO4 เป็นกรดแก่แตกตัวได้ 100%
H2SO4 + H2O —–> HSO4- + H3O+
2 mol 2 mol 2 mol
0.3 mol/dm3 0.3 mol/dm3 0.3 mol/dm3
ขั้นที่ 2 HSO4- เป็นกรดอ่อนจะแตกตัวบางส่วนเกิดภาวะสมดุล ความสัมพันธ์ระหว่างความเข้มข้นของสาร
ณ ภาวะสมดุลเป็นดังนี้
HSO4- + H2O SO42- + H3O+
0.3-x mol/dm3 x mol/dm3 x mol/dm3
แต่ในระดับมัธยม มักกำหนดให้ H2SO4 แตกตัว 100% จึงเขียนสมการและความสัมพันธ์ระหว่างโมลหรือความเข้มข้นของสารดังนี้
H2SO4 + 2H2O —–> SO42- + 2H3O+
2 mol 2 mol 4 mol
0.3 mol/dm3 0.3 mol/dm3 0.6 mol/dm3
0.625×10-4 mol/dm3 0.625×10-4 mol/dm3 1.25×10-4 mol/dm3
ดังนั้น ความเข้มข้นของไฮโดรเนียม = 2 เท่าของความเข้มข้น H2SO4 หรือ [H3O+] = 2[H2SO4] |
การแตกตัวของเบสแก่
เบสแก่ หมายถึงเบสที่เมื่อละลายน้ำแล้วสามารถแตกตัวเป็นไอออนได้ 100 %
ตัวอย่างเบสแก่ ได้แก่
สูตรเคมี
|
ชื่อเบส
|
LiOH
|
ลิเทียมไฮดรอกไซด์(lithium hydroxide)
|
NaOH
|
โซเดียมไฮดอรกไซด์ (sodium hydroxide)
|
KOH
|
โพแตสเซียมไฮดรอกไซด์(potassium hydroxide)
|
RbOH
|
รูบิเดียมไฮดรอกไซด์(rubidium hydroxide )
|
CsOH
|
ซีเซียมไฮดรอกไซด์(caesium hydroxide)
|
Ca(OH)2
|
แคลเซียมไฮดรอกไซด์(calcium hydroxide)
|
Ba(OH)2
|
แบเรียมไฮดรอกไซด์(balium hydroxide)
|
Sr(OH)2
|
สทรอนเชียมไฮดรอกไซด์(strontrium hydroxide)
|
สารประกอบไฮดรอกไซด์ของธาตุหมู่ 1 ซึ่งมีสูตรทั่วไป XOH เมื่อละลายน้ำจะแตกตัวให้ไอออนบวกและไฮดรอกไซด์ไอออน โดยโมลหรือความเข้มข้นของไอออนบวก ไฮดรอกไซด์ไอออนและเบสจะเท่ากัน ดังสมการ
XOH(aq) ——> X+(aq) + OH-(aq)
ตัวอย่าง NaOH(aq) ——> Na+(aq) + OH-(aq)
KOH(aq) ——> K+(aq) + OH-(aq)
2 mol 2 mol 2 mol
0.5 mol/dm3 0.5 mol/dm3 0.5 mol/dm3
สรุป สำหรับเบสแก่ XOH
[OH-] = [XOH-]
|
สารประกอบไฮดรอกไซด์ของธาตุหมู่ 2 ซึ่งมีสูตรทั่วไป Y(OH)2 เมื่อละลายน้ำจะแตกตัวให้ไอออนบวกและไฮดรอกไซด์ไอออน โดยโมลหรือความเข้มข้นของไฮดรอกไซด์ไอออนจะเป็นสองเท่าของโมลหรือความเข้มข้นของไอออนบวกและเบส ดังสมการ
Y(OH)2(aq) ——> Y2+(aq) + 2OH-(aq)
ตัวอย่าง Ca(OH)2(aq) ——> Ca2+(aq) + 2OH-(aq)
Ba(OH)2(aq) ——> Ba2+(aq) + 2OH-(aq)
2 mol 2 mol 4 mol
0.3 mol/dm3 0.3 mol/dm3 0.6 mol/dm3
0.25×10-4 mol/dm3 0.25×10-4 mol/dm3 0.50×10-4 mol/dm3
สรุป สำหรับเบส Y(OH)2
[OH-] = 2[Y(OH)2]
|
ตัวอย่างการคำนวณเกี่ยวกับการแตกตัวของกรดแก่และเบสแก่
ตัวอย่างที่ 1 จงคำนวณหา [H3O+] , [NO3-] ในสารละลาย 0.015 M HNO3
วิธีทำ HNO3 +H2O → H3O+ + NO3-
0.015
เพราะฉะนั้น [H3O+] = [NO3-] = 0.015 โมล/ ลิตร
ตัวอย่างที่ 2 ถ้า KOH 0.1 โมล ละลายน้ำและสารละลายมีปริมาตร 2 ลิตร ในสารละลาย
จะมีไอออนใดบ้างอย่างละกี่โมลต่อลิตร
วิธีทำ KOH (s) → K+ (aq) + OH- (aq)
0.1โมล/ 2 ลิตร
สารละลาย KOH 2 ลิตร มี KOH 0.1 โมล
สารละลาย KOH 1 ลิตร มี KOH = 0.05 โมล/ ลิตร
ดังนั้น KOH จะแตกตัวให้ K+ และ OH- อย่างละ 0.05 โมล/ ลิตร
ไม่มีความคิดเห็น:
แสดงความคิดเห็น