การแตกตัวของน้ำบริสุทธิ์
การแตกตัวเป็นไอออนของน้ำ
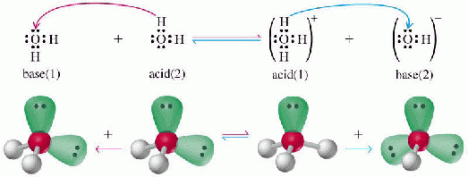
น้ำเป็นอิเล็กโทรไลต์ที่อ่อนมาก จึงทำให้แตกตัวได้น้อยมาก ดังนั้นการนำไฟฟ้าของน้ำจะน้อย จนไม่สามารถตรวจสอบได้ด้วยการนำไฟฟ้า ผ่านหลอดไฟ แต่ตรวจได้ด้วยเครื่องวัดกระแส (แอมมิเตอร์) ด้วยเหตุนี้จึงมีการอนุโลมให้น้ำบริสุทธิ์เป็นสารนอนอิเล็กโทรไลต์ตามทฤษฎีของเบรินสเตต – ลาวรี กล่าวว่า น้ำ ทำหน้าที่เป็นทั้งกรดและเบส ไอออนที่เกิดขึ้นจากการแตกตัวของน้ำนั้นจะมีการถ่ายเทโปรตอนกันเอง เรียกว่า
ออโตไอออนไนเซชัน ดังรูป
ออโตไอออนไนเซชัน ดังรูป
โมเลกุลของน้ำที่เสีย H+ จะเปลี่ยนเป็น OH- ซึ่งมีประจุลบและโมเลกุลของน้ำที่ได้รับ H+ จะเปลี่ยนเป็น H3O+ ซึ่งมีประจุบวก เราอาจเขียนสมการกรด- เบส ได้ง่ายๆ ดังนี้
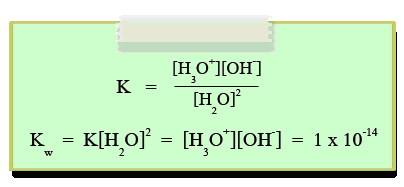
เนื่องจากระบบนี้อยู่ในภาวะสมดุล สามารถเขียนสมการค่าคงที่สมดุลของ H2O ได้ดังนี้
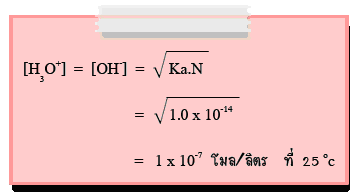
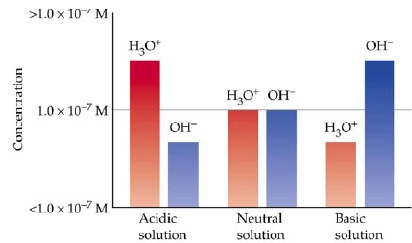
Kw คือค่าคงที่การแตกตัวของน้ำ มีค่าเท่ากับ 1 x 10-14ที่ 250C เนื่องจากน้ำบริสุทธิ์แตกตัวเป็นไอออนจะให้ความเข้มข้นของ H3O+ และOH- เท่ากัน
นั่นคือ น้ำบริสุทธิ์ที่อุณหภูมิ 25°C มีความเข้มข้นของไฮโดรเนียมไอออน(H3O+) เท่ากับความเข้มข้นของไฮดรอกไซด์ไอออน(OH-)
= 1.0 x 10-7 mol/dm3
= 1.0 x 10-7 mol/dm3
ดังนั้น น้ำบริสุทธิ์จึงมีสภาพเป็นกลางเนื่องจากปริมาณ H3O+ เท่ากับ OH- ค่าคงที่สมดุลของน้ำมีค่าเปลี่ยนแปลงตามอุณหภูมิ แสดงดังตารางต่อไปนี้
ตารางค่า Kw ของน้ำที่อุณหภูมิต่างๆ
อุณหภูมิ(0C)
|
Kw
|
0
10
20
25
30
40
50
60
|
0.114 x 10-14
0.296 x 10-14
0.681 x 10-14
1.010 x 10-14
1.470 x 10-14
2.920 x 10-14
5.470 x 10-14
9.610 x 10-14
|
อ้างอิง
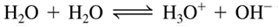
ไม่มีความคิดเห็น:
แสดงความคิดเห็น