ปฏิกิริยาไฮโดรไลซิส คือ ปฏิกิริยาของสารใดๆ ที่ทำปฏิกิริยาแล้วได้ผลิตภัณฑ์เป็นน้ำกับสารใดๆ
ไฮโดรไลซีสของเกลือ หมายถึง ปฏิกิริยาระหว่างเกลือกับน้ำ ซึ่งเกลือเป็นอิเล็กโทรไลต์แก่เมื่อละลายน้ำแล้วจะแตกตัวออกเป็นไอออนบวกและลบทั้งหมด ดังนั้นสมบัติของสารละลายเกลือจึงขึ้นอยู่กับไอออนบวกและลบในสารละลายนั้น ไอออนบางตัวสามารถทำปฏิกิริยากับน้ำและให้ H+ หรือ OH-ได้ จึงเรียกว่า ปฏิกิริยาไฮโดรไลซีส เช่น
สรุปได้ว่า ถ้าไอออนลบของเกลือเกิดปฏิกิริยาไฮโดรไลซีสจะทำให้สารละลายแสดงความเป็นเบส แต่ถ้าไอออนบวกของเกลือเกิดปฏิกิริยาไฮโดรไลซีส จะทำให้สารละลายแสดงความเป็นกรด หลักในการพิจารณาว่าไอออนลบใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณา ดังนี้
1. ไอออนลบของกรดแก่ เช่น Cl-, Br-, I-, NO3- และ ClO4- จะไม่ทำปฏิกิริยากับน้ำจึงทำให้ไม่มีผลต่อความเป็นกรด – เบสของสารละลาย
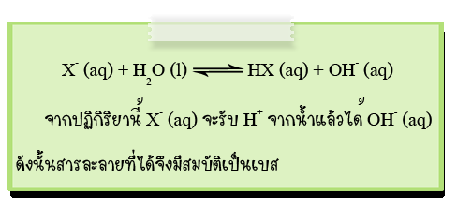
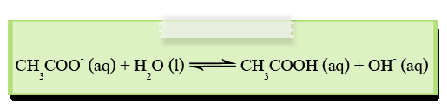
2. ไอออนลบของกรดอ่อน เช่น CH3COO-, ClO-, CN- และ CO32- จะรับโปรตอนจากน้ำทำให้เกิดปฏิกิริยาไฮโดรไลซีสได้สารละลายที่มีความเป็นเบส เช่น
หลักในการพิจารณาว่าไอออนบวกใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณาดังนี้
1. ไอออนบวกของโลหะหมู่ IA หรือ IIA (ยกเว้น Be) ได้แก่ Li+, Na+, K+, Mg2+, Ca2+และ Ba2+ จะไม่เกิดปฏิกิริยาไฮโดรไลซีส รวมถึงไอออนบวกของเบสแก่ทั้งหมดด้วย
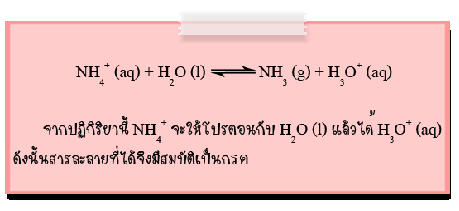
2. NH3+ ของเกลือแอมโมเนียม จะเกิดปฏิกิริยาไฮโดรไลซีสจึงทำให้สารละลายเป็นกรด
การไฮโดรไลซีสของเกลือ แบ่งออกเป็น 5 ประเภท ดังนี้
1. การไฮโดรไลซีสที่เกิดจากกรดแก่และเบสแก่
เกลือประเภทนี้เมื่อละลายน้ำจะไม่เกิดปฏิกิริยาไฮโดรไลซีส เพราะไอออนบวกจากเบสแก่และไอออนลบจากกรดแก่ต่างก็ไม่ทำปฏิกิริยากับน้ำ จึงทำให้ค่า pH ของสารละลายไม่เปลี่ยนแปลง (เป็นกลาง) คือ มีปริมาณ[H3O+] และ [OH-] เท่ากัน ดังนั้น pH ของสารละลายจึงเท่ากับ 7
2. การไฮโดรไลซีสที่เกิดจากกรดอ่อนกับเบสแก่
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนลบจากกรดอ่อนซึ่งมีสมบัติเป็นคู่เบสโดยเกิดปฏิกิริยาไฮโดรไลซีสกับน้ำได้ OH- ไอออน ดังนั้นสารละลายจึงมีสมบัติเป็นเบส(pH > 7) เช่น CH3COONa , KCN , NaClO
3. การไฮโดรไลซีสที่เกิดจากกรดแก่กับเบสอ่อน
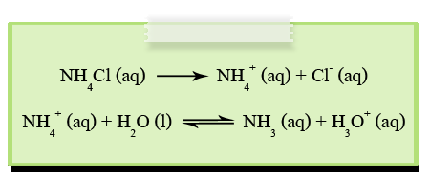
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนบวกจากเบสที่เป็นคู่กรด โดยเกิดปฏิกิริยาไฮโดรไลซีสกับน้ำให้ H3O+ ดังนั้นสารละลายจึงแสดงสมบัติเป็นกรด (pH < 7)ส่วนไอออนลบจากกรดแก่ จะไม่เกิดปฏิกิริยาไฮโดรไลซีส เช่น NH4Cl , (NH4)2SO4
4. การไฮโดรไลซีสที่เกิดจากกรดอ่อนและเบสอ่อน
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนบวกและลบ ไอออนบวกจะเกิดปฏิกิริยาไฮโดรไลซีสได้ H3O+ ส่วนไอออนลบจะได้ OH- ดังนั้นความเป็นกรด – เบสจึงขึ้นอยู่กับว่าไอออนบวกหรือลบใดเกิดปฏิกิริยาการไฮโดรไลซีสได้ดีกว่ากัน โดยพิจารณาจากค่าคงที่ของการแตกตัวของคู่เบส (Kb) หรือของคู่กรด (Ka) เช่น NH4CN
เนื่องจาก ค่า Kb > Ka แสดงว่า CN- เกิดปฏิกิริยาไฮโดรไลซีสได้ดีกว่า NH4+จึงแสดงสมบัติเป็นเบสที่มีค่า pH > 7
5. การไฮโดรไลซีสไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก
ไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก เช่น CO32-, PO43- จะเกิดปฏิกิริยาการไฮโดรไลซีสได้หลายขั้น เนื่องจากสามารถรับ H+ จาก H2O ได้มากกว่า 1 โปรตอน เช่น
Na+ ไม่เกิดปฏิกิริยาไฮโดรไลซีส เพราะมาจาก เบสแก่ NaOH ส่วน CO32- (aq)เกิดปฏิกิริยาการไฮโดรไลซีสได้ 2 ขั้นตอนดังนี้
อ้างอิง




ไม่มีความคิดเห็น:
แสดงความคิดเห็น