สารละลายบัฟเฟอร์มี 2 ประเภท
1) บัฟเฟอร์กรด (Acid buffer solution) เกิดจากสารละลายของกรดอ่อนผสมกับสารละลายเกลือของกรดอ่อนชนิดนั้น สารละลายบัฟเฟอร์ประเภทนี้มี pH < 7 เช่น
CH3COOH (กรดอ่อน) + CH3COONa (เกลือของกรดอ่อน)
HCN (กรดอ่อน) + KCN (เกลือของกรดอ่อน)
H2S(กรดอ่อน) + Na2S (เกลือของกรดอ่อน)
H2CO3(กรดอ่อน) + NaHCO3 (เกลือของกรดอ่อน)
2) บัฟเฟอร์เบส (Basic buffer solution) เกิดจากสารละลายของเบสอ่อนผสมกับสารละลายเกลือของเบสอ่อนนั้น สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เช่น
NH3 (เบสอ่อน) + NH4Cl (เกลือของเบสอ่อน)
NH3 (เบสอ่อน) + NH4NO3 (เกลือของเบสอ่อน)
Fe(OH)2 (เบสอ่อน) + FeCl2 (เกลือของเบสอ่อน)
Fe(OH)3 (เบสอ่อน) + FeCl3 (เกลือของเบสอ่อน)
วิธีเตรียมสารละลายบัฟเฟอร์
1. เตรียมโดยตรงจากการผสมสารละลายของกรดอ่อนกับสารละลายเกลือของกรดอ่อนนั้น หรือผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนนั้น ดังรูป
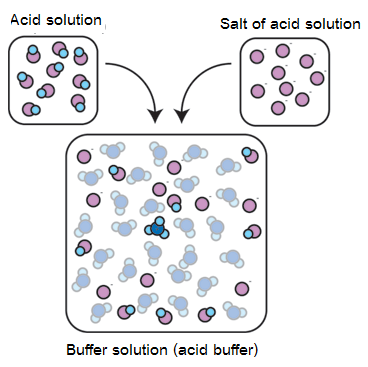
2. เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
2.1 บัฟเฟอร์กรด เตรียมโดยใช้สารละลสยของกรดอ่อนที่มากเกินพอ ทำปฏิกิริยากับเบส (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่ากรดอ่อนจนถูกใช้หมด) เช่น
HF(aq) + NaOH(aq) ↔ NaF(aq) + H2O(l)
(กรดอ่อนมากเกินพอ) (หมด) (เกลือของกรดอ่อนที่เกิดขึ้น)
(มีเหลือ)
ถ้าใช้ HF มากเกินพอจะมี HF เหลืออยู่ เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้ว NaOH จะหมดไป ในระบบจะเป็นสารละลายผสมระหว่างHF ส่วนที่เหลือ กับ NaF ที่เกิดขึ้น
จึงเป็นบัฟเฟอร์กรด (กรดอ่อน+เกลือของกรดอ่อนนั้น) ดังรูป
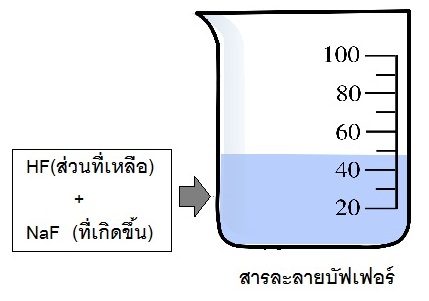 2.2 บัฟเฟอร์เบส เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ ทำปฎิกิริยากับสารละลายกรดกรด (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่น
2.2 บัฟเฟอร์เบส เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ ทำปฎิกิริยากับสารละลายกรดกรด (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่น
HCl(aq) + NH4OH(aq) → NH4Cl(aq) + H2O(l)
(หมด) (มากเกินพอ) (เกิดขึ้น)
มีเหลือ
เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว HCl จะหมดไปแต่ NH4OH ยังมีเหลือ ฉะนั้นในระบบจะเป็นสารละลายผสมระหว่าง NH4OH สว่นที่เหลือ กับ NH4Cl ที่เกิดขึ้น จึงเป็นสารละลายบัฟเฟอร์เบส (เบสอ่อน + เกลือของเบสอ่อนนั้น)
การควบคุมค่า pH ของสารละลายบัฟเฟอร์
ส่วนประกอบของสารละลายบัฟเฟอร์ จะแตกต่างจากสารละลายของกรดอ่อนหรือเบสอ่อน คือ ในสารละลายกรดอ่อนจะมีอนุภาคของกรดอ่อนละลายอยู่มาก แต่อนุภาคของคู่เบสมีน้อย เช่น
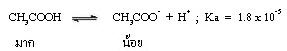
แต่เมื่อผสมสารละลายเกลือของ CH3COOH เช่น CH3COONa ซึ่งเป็นสารไอออนิกที่ละลายน้ำได้ดี แตกตัวเป็นไอออนได้ทั้งหมด จึงมี CH3COO- อยู่เป็นจำนวนมาก ดังนี้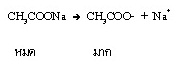
เมื่อนำมาผสมกันจะมีสมบัติเป็นสารละลายบัฟเฟอร์ ให้สังเกตว่าในสารละลายจะมีกรดอ่อนและคูเบสของกรดอ่อนเป็นจำนวนมากทั้งคู่ ดังสมการ
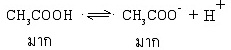
การที่ในสารละลายมี กรดอ่อนและคู่เบสของกรดอ่อนนั้นอยู่เป็นจำนวนมาก ทำให้สามารถควบคุมระดับความเป็นกรด-เบสของสารละลายเอาไว้ได้จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ เพราะ ...
- เมื่อเติมกรด (H+) กรดหรือ H+ ที่เติมลงไปก็จะรวมตัวกับ CH3COO- เกิดปฏิกิริยาย้อนกลับเปลี่ยนให้อยู่ในรูป CH3COOH ได้เกือบทั้งหมด ทำให้ความเข้มข้น H+ เพิ่มขึ้นน้อยกว่า
จำนวนที่เติมลงไปจริง pH จึงแปลี่ยนแปลงน้อยกว่าปริมาณของ H+ ที่เติมลงไปจริง
(คลิ้ก ฃมการควบคุม pH ของสารละลายบัฟเฟอร์กรด)
- เมื่อเติมเบส (OH-) เบสหรือ OH- ที่เติมลงไปก็จะรวมตัวกับ H+ เปลี่ยนให้มาอยู่ในรูป H2O ทำให้ H+ ลดลงในตอนแรก แต่ในเวลาเดียวกัน CH3COOH ซึ่งมีอยู่มาก
(สังเกตทางซ้ายของสมการ)ก็จะเกิดการแตกตัวให้ H+ มาทดแทนได้เกือบทั้งหมด ทำให้ปริมาณของ H+ จึงลดลงน้อยกว่าปริมาณของ OH- ที่เติม pH จึงเปลี่ยนแปลงน้อยกว่าปริมาณของ OH-
ที่เติมลงไปจริง
สำหรับสารละลายบัฟเฟอร์เบสก็จะมีลักษณะเช่นเดียวกัน คือเบสอ่อนแตกตัวได้น้อย เช่น การละลายของ NH4OH ดังสมการ ;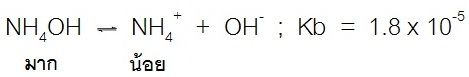
แต่สำหรับเกลือของเบสชนิดนี้ เช่น NH4Cl จะละลายน้ำได้ดี ดังสมการ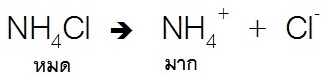
เมื่อผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนเข้าด้วยกัน ในสารละลายที่ได้จากการผสมก็จะมีมากทั้งตัวของเบสอ่อนลัคู่กรดของมัน จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ ดังสมการ
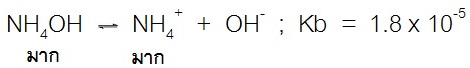
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์เบส)
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์กรดเมื่อเติมเบสหรือเบส)
การหา pH ของสารละลายบัฟเฟอร์ 1. สารละลายบัฟเฟอร์กรดหา pH จากสมการ
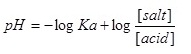
ตัวอย่าง สารละลายบัฟเฟอร์ประกอบด้วย สารละลายกรดอะซิติกกับสารละลายโซเดียมอะซิเตต ซึ่งเข้มข้น 0.1 โมล/ลิตรเท่ากันและมีปริมาตร 100 cm3 เท่ากันด้วย ถ้า Ka ของกรดอะซิติกเท่ากับ
1.8 x 10-5 จงหา pH ของสารละลายบัปเฟอร์นี้
วิธีทำ
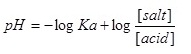
= -log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 + log 1
= 5 – 0.26
= 4.24
2. สารละลายบัฟเฟอร์เบส หา pH ได้ดังนี้
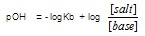
จากนั้นจึงหา pH จากสมการ
pH = 14 – pOH
ตัวอย่าง สารละลายบัฟเฟอร์ที่เกิดจากผสมสารละลายเบสอ่อน NH4OH และเกลือ NH4Cl ซึ่งมีความเข้มข้น 0.1 โมล/ลิตรเท่ากัน และมีปริมาตร 100cm3 เท่ากันด้วย ถ้า Kb ของ NH4OH
เท่ากับ 1.8 x 10-5 สารละลายบัฟเฟอร์นี้มี pH เท่าไร
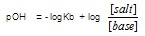
= - log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 +log 1
= 5 – 0.26
= 4.74
pH = 14 – pOH
= 14 – 4.74
= 9.26
การเตรียมสารละลายบัฟเฟอร์ สารละลายบัฟเฟอร์เป็นสารละลายที่มีราคาแพง ใช้ในงานเฉพาะแต่ละด้าน เช่น ในการปรับเพื่อตั้งค่าให้ถูกต้องของเครื่องมือวิทยาศาสตร์บางชนิด สารละลายบัฟเฟอร์สำหรับการตั้งค่า
pH meter ราคา 690 บาท / 500 ml

สารละลายบัฟเฟอร์จะมีค่า pH ต่าง ๆ กัน การเตรียมสารละลายบัฟเฟอร์ให้มี pH ตามที่ต้องการให้ดูจากค่า pKa ของกรดอ่อน เช่น ถ้ากรดอ่น HA มีค่า Ka = 1.0 x 10-6 ค่า pKa = 6 กรดอ่อนชนิดนี้จะเหมาะสำหรับเตรียมสารละลายบัฟเฟอร์ที่มี pH=6
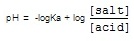
จากสมการจะเห็นว่า [salt] และ [acid] จะมีผลต่อ pH ของสารละลายบัฟเฟอร์ แต่พบว่าถ้า [salt] = [acid] สารละลายบัฟเฟอร์จะมีคุณภาพดีที่สุด
ถ้า [salt] = [acid] ;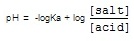
= -log 1.0 x 10-6 + log 1
= 6
ถ้า [salt] = 2เท่าของ [acid] ;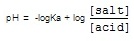
= -log 1.0 x 10-6 + log 2
= 6.3
ถ้า [acid] = 2เท่าของ[salt];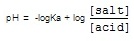
= -log 1.0 x 10-6 + log 0.5
= 6 - 0.3
= 5.7
1) บัฟเฟอร์กรด (Acid buffer solution) เกิดจากสารละลายของกรดอ่อนผสมกับสารละลายเกลือของกรดอ่อนชนิดนั้น สารละลายบัฟเฟอร์ประเภทนี้มี pH < 7 เช่น
CH3COOH (กรดอ่อน) + CH3COONa (เกลือของกรดอ่อน)
HCN (กรดอ่อน) + KCN (เกลือของกรดอ่อน)
H2S(กรดอ่อน) + Na2S (เกลือของกรดอ่อน)
H2CO3(กรดอ่อน) + NaHCO3 (เกลือของกรดอ่อน)
2) บัฟเฟอร์เบส (Basic buffer solution) เกิดจากสารละลายของเบสอ่อนผสมกับสารละลายเกลือของเบสอ่อนนั้น สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เช่น
NH3 (เบสอ่อน) + NH4Cl (เกลือของเบสอ่อน)
NH3 (เบสอ่อน) + NH4NO3 (เกลือของเบสอ่อน)
Fe(OH)2 (เบสอ่อน) + FeCl2 (เกลือของเบสอ่อน)
Fe(OH)3 (เบสอ่อน) + FeCl3 (เกลือของเบสอ่อน)
วิธีเตรียมสารละลายบัฟเฟอร์
1. เตรียมโดยตรงจากการผสมสารละลายของกรดอ่อนกับสารละลายเกลือของกรดอ่อนนั้น หรือผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนนั้น ดังรูป

2. เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
2.1 บัฟเฟอร์กรด เตรียมโดยใช้สารละลสยของกรดอ่อนที่มากเกินพอ ทำปฏิกิริยากับเบส (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่ากรดอ่อนจนถูกใช้หมด) เช่น
HF(aq) + NaOH(aq) ↔ NaF(aq) + H2O(l)
(กรดอ่อนมากเกินพอ) (หมด) (เกลือของกรดอ่อนที่เกิดขึ้น)
(มีเหลือ)
ถ้าใช้ HF มากเกินพอจะมี HF เหลืออยู่ เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้ว NaOH จะหมดไป ในระบบจะเป็นสารละลายผสมระหว่างHF ส่วนที่เหลือ กับ NaF ที่เกิดขึ้น
จึงเป็นบัฟเฟอร์กรด (กรดอ่อน+เกลือของกรดอ่อนนั้น) ดังรูป
 2.2 บัฟเฟอร์เบส เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ ทำปฎิกิริยากับสารละลายกรดกรด (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่น
2.2 บัฟเฟอร์เบส เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ ทำปฎิกิริยากับสารละลายกรดกรด (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่นHCl(aq) + NH4OH(aq) → NH4Cl(aq) + H2O(l)
(หมด) (มากเกินพอ) (เกิดขึ้น)
มีเหลือ
เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว HCl จะหมดไปแต่ NH4OH ยังมีเหลือ ฉะนั้นในระบบจะเป็นสารละลายผสมระหว่าง NH4OH สว่นที่เหลือ กับ NH4Cl ที่เกิดขึ้น จึงเป็นสารละลายบัฟเฟอร์เบส (เบสอ่อน + เกลือของเบสอ่อนนั้น)
การควบคุมค่า pH ของสารละลายบัฟเฟอร์
ส่วนประกอบของสารละลายบัฟเฟอร์ จะแตกต่างจากสารละลายของกรดอ่อนหรือเบสอ่อน คือ ในสารละลายกรดอ่อนจะมีอนุภาคของกรดอ่อนละลายอยู่มาก แต่อนุภาคของคู่เบสมีน้อย เช่น
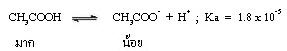
แต่เมื่อผสมสารละลายเกลือของ CH3COOH เช่น CH3COONa ซึ่งเป็นสารไอออนิกที่ละลายน้ำได้ดี แตกตัวเป็นไอออนได้ทั้งหมด จึงมี CH3COO- อยู่เป็นจำนวนมาก ดังนี้
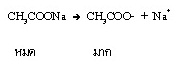
เมื่อนำมาผสมกันจะมีสมบัติเป็นสารละลายบัฟเฟอร์ ให้สังเกตว่าในสารละลายจะมีกรดอ่อนและคูเบสของกรดอ่อนเป็นจำนวนมากทั้งคู่ ดังสมการ
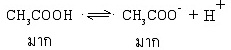
การที่ในสารละลายมี กรดอ่อนและคู่เบสของกรดอ่อนนั้นอยู่เป็นจำนวนมาก ทำให้สามารถควบคุมระดับความเป็นกรด-เบสของสารละลายเอาไว้ได้จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ เพราะ ...
- เมื่อเติมกรด (H+) กรดหรือ H+ ที่เติมลงไปก็จะรวมตัวกับ CH3COO- เกิดปฏิกิริยาย้อนกลับเปลี่ยนให้อยู่ในรูป CH3COOH ได้เกือบทั้งหมด ทำให้ความเข้มข้น H+ เพิ่มขึ้นน้อยกว่า
จำนวนที่เติมลงไปจริง pH จึงแปลี่ยนแปลงน้อยกว่าปริมาณของ H+ ที่เติมลงไปจริง
(คลิ้ก ฃมการควบคุม pH ของสารละลายบัฟเฟอร์กรด)
- เมื่อเติมเบส (OH-) เบสหรือ OH- ที่เติมลงไปก็จะรวมตัวกับ H+ เปลี่ยนให้มาอยู่ในรูป H2O ทำให้ H+ ลดลงในตอนแรก แต่ในเวลาเดียวกัน CH3COOH ซึ่งมีอยู่มาก
(สังเกตทางซ้ายของสมการ)ก็จะเกิดการแตกตัวให้ H+ มาทดแทนได้เกือบทั้งหมด ทำให้ปริมาณของ H+ จึงลดลงน้อยกว่าปริมาณของ OH- ที่เติม pH จึงเปลี่ยนแปลงน้อยกว่าปริมาณของ OH-
ที่เติมลงไปจริง
สำหรับสารละลายบัฟเฟอร์เบสก็จะมีลักษณะเช่นเดียวกัน คือเบสอ่อนแตกตัวได้น้อย เช่น การละลายของ NH4OH ดังสมการ ;
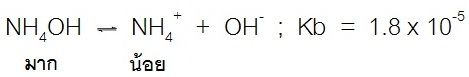
แต่สำหรับเกลือของเบสชนิดนี้ เช่น NH4Cl จะละลายน้ำได้ดี ดังสมการ

เมื่อผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนเข้าด้วยกัน ในสารละลายที่ได้จากการผสมก็จะมีมากทั้งตัวของเบสอ่อนลัคู่กรดของมัน จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ ดังสมการ
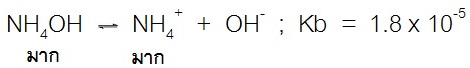
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์เบส)
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์กรดเมื่อเติมเบสหรือเบส)
การหา pH ของสารละลายบัฟเฟอร์ 1. สารละลายบัฟเฟอร์กรดหา pH จากสมการ
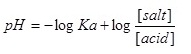
ตัวอย่าง สารละลายบัฟเฟอร์ประกอบด้วย สารละลายกรดอะซิติกกับสารละลายโซเดียมอะซิเตต ซึ่งเข้มข้น 0.1 โมล/ลิตรเท่ากันและมีปริมาตร 100 cm3 เท่ากันด้วย ถ้า Ka ของกรดอะซิติกเท่ากับ
1.8 x 10-5 จงหา pH ของสารละลายบัปเฟอร์นี้
วิธีทำ
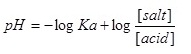
= -log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 + log 1
= 5 – 0.26
= 4.24
2. สารละลายบัฟเฟอร์เบส หา pH ได้ดังนี้
จากนั้นจึงหา pH จากสมการ
pH = 14 – pOH
ตัวอย่าง สารละลายบัฟเฟอร์ที่เกิดจากผสมสารละลายเบสอ่อน NH4OH และเกลือ NH4Cl ซึ่งมีความเข้มข้น 0.1 โมล/ลิตรเท่ากัน และมีปริมาตร 100cm3 เท่ากันด้วย ถ้า Kb ของ NH4OH
เท่ากับ 1.8 x 10-5 สารละลายบัฟเฟอร์นี้มี pH เท่าไร
= - log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 +log 1
= 5 – 0.26
= 4.74
pH = 14 – pOH
= 14 – 4.74
= 9.26
การเตรียมสารละลายบัฟเฟอร์ สารละลายบัฟเฟอร์เป็นสารละลายที่มีราคาแพง ใช้ในงานเฉพาะแต่ละด้าน เช่น ในการปรับเพื่อตั้งค่าให้ถูกต้องของเครื่องมือวิทยาศาสตร์บางชนิด สารละลายบัฟเฟอร์สำหรับการตั้งค่า
pH meter ราคา 690 บาท / 500 ml

สารละลายบัฟเฟอร์จะมีค่า pH ต่าง ๆ กัน การเตรียมสารละลายบัฟเฟอร์ให้มี pH ตามที่ต้องการให้ดูจากค่า pKa ของกรดอ่อน เช่น ถ้ากรดอ่น HA มีค่า Ka = 1.0 x 10-6 ค่า pKa = 6 กรดอ่อนชนิดนี้จะเหมาะสำหรับเตรียมสารละลายบัฟเฟอร์ที่มี pH=6
จากสมการจะเห็นว่า [salt] และ [acid] จะมีผลต่อ pH ของสารละลายบัฟเฟอร์ แต่พบว่าถ้า [salt] = [acid] สารละลายบัฟเฟอร์จะมีคุณภาพดีที่สุด
ถ้า [salt] = [acid] ;
= -log 1.0 x 10-6 + log 1
= 6
ถ้า [salt] = 2เท่าของ [acid] ;
= -log 1.0 x 10-6 + log 2
= 6.3
ถ้า [acid] = 2เท่าของ[salt];
= -log 1.0 x 10-6 + log 0.5
= 6 - 0.3
= 5.7
อ้างอิง
ไม่มีความคิดเห็น:
แสดงความคิดเห็น