การแตกตัวของกรดอ่อน monoprotic
กรดอ่อนหรือเบสอ่อนเมื่อละลายน้ำจะแตกตัวได้เพียงบางส่วน ในสารละลายจึงมีไอออนและโมเลกุลที่ไม่แตกตัว ดังนั้นจึงเกิดการเปลี่ยนแปลงผันกลับได้เกิดภาวะสมดุลสารละลายกรดอ่อน-เบสอ่อน จัดว่าเป็นสารละลายอิเล็กโทรไลต์อ่อน
ตัวอย่างกรดอ่อน monoprotic
ตัวอย่างกรดอ่อน monoprotic
HCOOH
| formic acid |
HNO2
| nitrous acid |
CH3COOH
| acetic acid |
HF
| hydrofluoric acid |
HCN
| hydrocyanic acid |
HClO2
| chlorous acid |
เมื่อกรดอ่อน HA แตกตัวจะให้ไอออนลบและ H3O+ ดังสมการ
HA + H2O → H3O+ + A-
ตัวอย่าง HCOOH + H2O → H3O+ + HCOO-
HClO4 + H2O → H3O+ + ClO4-
HCN + H2O → H3O+ + CN-
ความสัมพันธ์ระหว่างกรดอ่อนและไอออน ณ ภาวะสมดุล
พิจารณาการแตกตัวของกรด HA
| HA + H2O → H3O+ + A-
ความเข้มข้นเริ่มต้น Ca – 0 0
เปลี่ยนไป -x – +x +x
ความเข้มข้นที่สมดุล Ca-x – x x
|
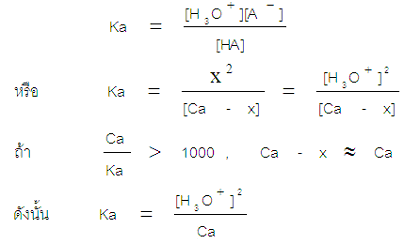
การแตกตัวของกรดอ่อน polyprotic
กรดอ่อนที่มี H มากกว่า 1 อะตอมจะแตกตัวให้ H3O+ มากกว่า 1 ไอออนเรียกกรดประเภทนี้ว่ากรดพอลิโปรติก
ตัวอย่างกรดอ่อน polyprotic
| H3PO4 | phosphoric acid |
| H3PO3 | phosphorous acid |
| H3BO3 | boric acid |
| H2CO3 | carbonic acid |
| H2SO3 | sulfurous acid |
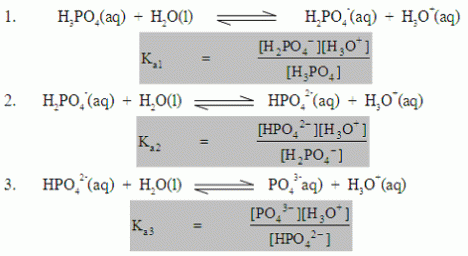
การแตกตัวของกรดประเภทนี้มีได้หลายขั้น แต่ละขั้นจะมีปริมาณการแตกตัวแตกต่าง
กันการแตกตัวของกรด H3PO4 เกิดได้ 3 ขั้นดังนี้
กรดพอลิโปรติก ถ้าแตกตัวให้ H3O+ 2 ไอออนเรียกว่ากรดไดโปรติก เช่น H2SO4ถ้าแตกตัวให้ H3O+ 3 ไอออนเรียกว่ากรดไตรโปรติก เช่น H3PO4 การแตกตัวของกรพอลิโปรติกจะมีมากกว่า 1 ขั้น และแต่ละขั้นจะมีค่า Ka เฉพาะตัว โดยทั่วไปค่า Ka1 มีค่ามากกว่าค่า Ka2 และค่า Ka2 มากกว่าค่า Ka3ในการเปรียบเทียบการแตกตัวของกรดจึงมีเปรียบเทียบจากค่า Ka1สำหรับกรด H3PO3 แม้จะมี H 3 อะตอมแต่สามารถเกิดการแตกตัวได้เพียง 2ขั้นเท่านั้น
การคำนวณหาความเข้มข้นของ H3O+ และ OH- ในสารละลายได้ เช่น
การคำนวณหาความเข้มข้นของ H3O+ และ OH- ในสารละลายได้ เช่น
1. สารละลาย HNO3 เข้มข้น 1 mol/dm3 จะแตกตัวให้ H3O+ และ NO3- อย่างละ 1 mol/dm3

2. สารละลายเบสแก่ NaOH เข้มข้น 0.1 mol/dm3 จะแตกตัวให้ Na+ และ OH- เข้มข้น
อย่างละ 0.1 mol/dm3
3. สารละลายเบสแก่ Ca(OH)2 เข้มข้น 1 mol/dm3 จะแตกตัวให้ Ca2+ 1 mol/dm3 แต่ให้
OH- 2 mol/dm3

H2SO4 แตกตัวได้ 2 ขั้น ดังนี้
การแตกตัวของกรดอ่อน - เบสอ่อน
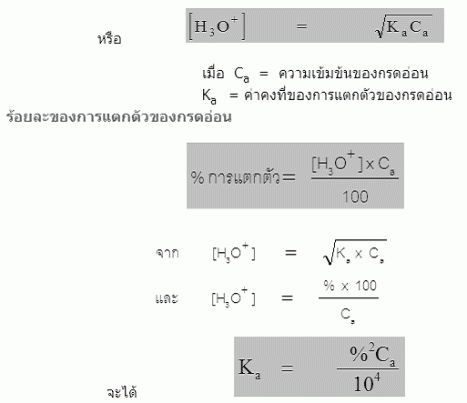
กรดอ่อนและเบสอ่อนจัดเป็นอิเล็กโทรไลต์อ่อน เมื่อละลายน้ำจึงแตกตัวได้ไม่หมด แตกตัวได้เพียงบางส่วนและเป็นส่วนที่น้อยมากเมื่อเทียบกับความเข้มข้นเริ่มต้นของกรดอ่อนหรือเบสอ่อน การแตกตัวของกรดอ่อนและเบสอ่อนจึงเป็นการเปลี่ยนแปลงที่ผันกลับได้ ณ ภาวะสมดุลจึงมีทั้งโมเลกุลของกรดอ่อนหรือเบสอ่อนและไอออนที่เกิดจากการแตกตัวของกรดอ่อนและเบสอ่อน การบอกความเข้มข้นของ H3O+ และ OH- ที่เกิดจากการแตกตัวของกรดอ่อนและเบสอ่อน นิยมบอกเป็นร้อยละเรียกว่า ร้อยละการแตกตัว(percent ionization : α) เช่น กรดอ่อน HAเข้มข้น 1 mol/dm3 แตกตัวได้ร้อยละ 5 หมายความว่าในสารละลายปริมาตร 1 dm3 มีกรด HA ละลายอยู่ 1 mol และเมื่อถึงสมดุลกรด HA แตกตัวไปเพียง 0.05 mol และเหลืออยู่ 0.95 mol
** ปริมาณการแตกตัวของกรดอ่อน นอกจากจะบอกเป็นร้อยละแล้ว ยังสามารถบอกโดยใช้ค่าคงที่สมดุล
ของปฏิกิริยาก็ได้ เรียกว่า ค่าคงที่สมดุลของกรด หรือ ค่าคงที่การแตกตัวของกรด (acid ionization
constant : Ka)
** ส่วนเบสอ่อน เรียกว่า ค่าคงที่สมดุลของเบส หรือ ค่าคงที่การแตกตัวของเบส (base ionization
constant : Kb) เช่น ถ้า MOH เป็นเบสอ่อน
ค่าคงที่การแตกตัวของกรด (Ka) และค่าคงที่การแตกตัวของเบส (Kb) เป็นค่าที่บอกให้ทราบว่ากรดอ่อน หรือเบสอ่อนนั้นแตกตัวเป็นไอออนได้มากน้อยเพียงใด
กรดที่มีค่า Ka สูงจะแตกตัวเป็นไอออนได้มากกว่ากรดที่มีค่า Ka ต่ำ และเบสที่มีค่า Kb สูงจะแตกตัวเป็นไอออนได้มากกว่าเบสที่มีค่า Kb ต่ำ กรดอ่อนที่มี H 1 อะตอม
ใน 1 โมเลกุล เช่น HA เรียกกรดประเภทนี้ว่า กรดโมโนโปรติก (monoprotic) ได้แก่ CH3COOH, HCOOH, HF, HCN เป็นต้น
อ้างอิง








ไม่มีความคิดเห็น:
แสดงความคิดเห็น